حسین رزقی اِسبو
I Love Genetic
حسین رزقی اِسبو
I Love Geneticاوربیتال مولکولی
برای مطالعه بیشتر به ادامه ی مطلب مراجعه فرمایید
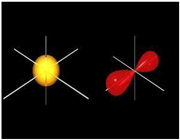 هنگام ایجاد یک پیوند بین دو اتم، اوربیتالهای اتمی آن ها با یکدیگر همپوشانی کرده و اوربیتالهای مولکولی را پدید میآورند. در این اوربیتالها، الکترونها در یک محیط مولکولی تحت تاثیر دو هسته قرار دارند و بر حسب قاعده آفبا در این اوربیتالها چیده میشوند.
هنگام ایجاد یک پیوند بین دو اتم، اوربیتالهای اتمی آن ها با یکدیگر همپوشانی کرده و اوربیتالهای مولکولی را پدید میآورند. در این اوربیتالها، الکترونها در یک محیط مولکولی تحت تاثیر دو هسته قرار دارند و بر حسب قاعده آفبا در این اوربیتالها چیده میشوند.اوربیتالهای مولکولی را با توجه به این که از همپوشانی کدام اوربیتال اتمی پدید آمده باشند،باحروف یونانی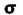 (سیگما) و
(سیگما) و  (پی) نمایش میدهند.
(پی) نمایش میدهند.
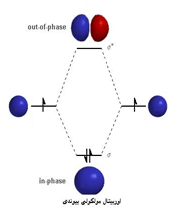
هنگام تشکیل یک پیوند، دو اوربیتال مولکولی حاصل میشود که با توجه به سطح انرژی، نسبت به اوربیتالهای اتمی به اوربیتالهای مولکولی پیوندی و ضد پیوندی شهرت دارند. به همان اندازه که اوربیتال مولکولی پیوندی، مولکول را پایدار میکند، اوربیتال مولکولی ضد پیوندی باعث ناپایداری پیوندی میشود.
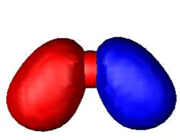
اوربیتال پیوندی
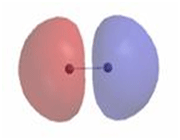
اوربیتال ضد پیوندی
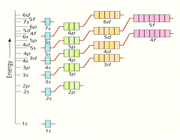
با توجه به نارسایی های نظریه پیوند ظرفیت، هوندا در سال 1928 و مولیکن در سال 1931 نظریه دیگری بر اساس مدل موج اتم در مورد چگونگی تشکیل پیوند کووالانسی ارائه دادند که نظریه اوربیتال مولکولی نام گرفته است و به کمک آن بسیاری از خواص مغناطیسی، ترازهای انرژی، خواص طیفی و ... را به روشنی میتوان توجیه کرد.
در این نظریه برعکس نظریه پیوند (که فقط دخالت لایه ظرفیت اتمها را در تشکیل پیوند در نظر میگیرد) تمام اوربیتال های اتم میتواند در تشکیل اوربیتال های مولکولی شرکت داشته باشد و این اوربیتال ها بین چندین اتم و حتی در سراسر مولکول گسترده یا غیر مستقرند.
علاوه بر اوربیتال های پیوندی و غیر پیوندی، اوربیتال های ضد پیوندی نیز در تشکیل پیوند و توجیه پایداری و یا ناپایداری مولکول در نظر گرفته میشود و به تعداد اوربیتال های اتمی شرکت کننده، اوربیتال های مولکول تشکیل میشود.
شرایط همپوشانی اوربیتال ها
برای اینکه اوربیتال های اتمی بتوانند در حد تشکیل پیوند با یکدیگر همپوشانی کنند، باید دو شرط زیر درباره آن ها برقرار باشد:
1. شرط انرژیفقط اوربیتال هایی میتوانند با یکدیگر همپوشانی کنند که، دریک سطح انرژی قرار داشته و یا سطوح انرژی آن ها به اندازه کافی به یکدیگر نزدیک باشد.
مثلا اوربیتال 3P یک اتم کلر می تواند فقط با اوربیتال 3P اتم دیگر کلر همپوشانی کند. اوربیتال S اتم H نمیتواند با اوربیتال1S یا 2S و … اتم کلر همپوشانی کند، زیرا در سطح انرژی بالاتری نسبت به آنها قرار دارد.
2. شرط تقارنفقط اوربیتال هایی میتوانند با یکدیگر همپوشانی کنند که نسبت به محور اصلی مولکول تقارن یکسانی داشته باشند. از این رو، مثلاً اوربیتال S که تقارن کروی دارد، در تشکیل مولکول های خطی میتواند با اوربیتال 2P که نسبت به محور اصلی مولکولی (محور Z) تقارن کامل دارد همپوشانی داشته باشد.
انواع اوربیتال های مولکولی
اوربیتال مولکولی پیوندی
اوربیتال مولکولی پیوندی اوربیتال مولکولی است که در آن چگالی در ناحیه بین هستهها زیاد است. انرژی دو الکترون که در اوربیتال مولکولی پیوندی قرار میگیرند، کمتر از هنگامی است که در اوربیتال های اتمی به وجود آورنده آن، قرار گرفته باشند.
اوربیتال مولکولی ضد پیوندی
اوربیتال مولکولی ضد پیوندی اوربیتال مولکولی است که در آن چگالی الکترونی در ناحیه بین هستهها کم است.انرژی دو الکترون که در اوربیتال مولکولی ضد پیوندی قرار میگیرند، بیشتر از هنگامی است که در اوربیتال های اتمی به وجود آورنده آن، قرار گرفته باشند.
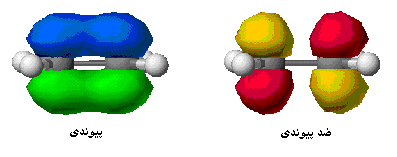
هر گاه دو اتم نتوانند به طریقی به هم نزدیک شوند که امکان همپوشانی اوربیتال های آن ها به وجود آید، همپوشانی اوربیتال ها صورت نمیگیرد و در نتیجه اوربیتال های اتمی به صورت غیر پیوندی در مولکول باقی خواهند ماند. اوربیتال های مولکولی را نیز با حروف یونانی 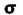 (سیگما) ،
(سیگما) ، 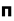 (پی) و ... نشانه گذاری میکنند.
(پی) و ... نشانه گذاری میکنند.
اوربیتال های مولکولی سیگما
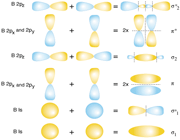
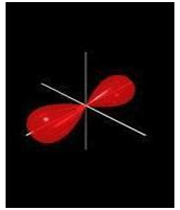
اگر تشکیل یک مولکول دو اتمی را از طریق نزدیک شدن اتم ها در امتداد یکی از محورها مثلاً x به صورت خطی در نظر بگیریم، دو اوربیتال اتمی (مثلا 1S) به یکدیگر نزدیک میشوند و در نتیجه همپوشانی، دو اوربیتال مولکولی پیوندی سیگما و ضد پیوندی سیگما را به وجود میآورند. تمام اوربیتال های سیگما، نسبت به محور بین دو هسته کاملا متقارنند و چرخش مولکول به دور این محور ، تغییر قابل مشاهدهای در شکل اوربیتال بوجود نمیآورد.
نمودار تراز انرژی تشکیل اوربیتال های مولکولی 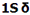 و
و 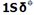 از اوربیتال های اتمی 1S دو اتم به شکل زیر میباشد:
از اوربیتال های اتمی 1S دو اتم به شکل زیر میباشد:
هر اوربیتال مولکولی میتواند دو الکترون با اسپین مخالف را در خود جای دهد. در مولکول هیدروژن، دو الکترون (با اسپین های جفت شده) اوربیتال 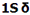 را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتالهای
را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتالهای 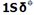
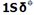 اشغال نشده است. تعداد پیوند (مرتبه پیوند)، در هر مولکول عبارت است از نصف تفاضل الکترونهای ضد پیوندی از الکترونهای پیوندی.
اشغال نشده است. تعداد پیوند (مرتبه پیوند)، در هر مولکول عبارت است از نصف تفاضل الکترونهای ضد پیوندی از الکترونهای پیوندی.برای H2 داریم:
1=2/(0-2) = مرتبه پیوند
در مورد ترکیب دو اتم هلیوم، باید مجموع چهار الکترون در دو اوربیتال مولکولی جای داده شوند. با جای دادن دو الکترون در اوربیتال 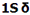 دو الکترون دیگر ناگزیر
دو الکترون دیگر ناگزیر 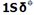 را اشغال میکنند. از این رو مرتبه پیوند مولکول فرضی He2 عبارتست از:
را اشغال میکنند. از این رو مرتبه پیوند مولکول فرضی He2 عبارتست از:
0=(2-2)1/2=مرتبه پیوند
لذا هلیوم به صورت مولکولی He2 نمیتواند وجود داشته باشد. اثر جدا کننده الکترون های ضد پیوندی، اثر اتصال دهنده الکترون های پیوندی را خنثی می کند. شواهدی در دست است که نشان می دهد یون های مولکولی+ H2 و+ He2 می توانند در شرایط ویژه ای وجود داشته باشند. ترکیب دو اوربیتال 2S ، اوربیتال های مولکولی و 2*S خ´ را بوجود میآورند که با اوربیتال های 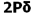 و
و 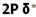 ناشی از ترکیب دو اوربیتال 1S مشابهند.
ناشی از ترکیب دو اوربیتال 1S مشابهند.

اما اوربیتال های مولکولی حاصل از ترکیب اوربیتال های اتمی 2P کمی پیچیدهترند. سه اوربیتال 2P هر اتم، در محورهای مختصات دکارتی z ، y ، x قرار دارند. اگر تشکیل یک مولکول دو اتمی از طریق نزدیک شدن سر به سر دو اوربیتال اتمی ( و یا ) صورت گیرد، در نتیجه همپوشانی، دو اوربیتال مولکولی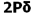 و
و 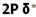 را بوجود میآورند .
را بوجود میآورند .
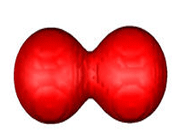
اوربیتال های مولکولی پی
اگر در تشکیل یک مولکول دو اتمی، دو اوربیتال اتمی (مثلا PZ) از پهلو بهم نزدیک شوند، دو اوربیتال مولکولی، یکیاوربیتال مولکولی پیوندی پی و دیگری اوربیتال مولکولی ضد پیوندی پی ستاره را بوجود میآورند.

اوربیتال های پای نسبت به محور بین دو هسته تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال P از پهلو، به تشکیل اوربیتال پای میانجامد، که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند. در هر حال اثر نهایی اوربیتال پای ، بهم نگهداشتن مولکول است. اوربیتال پای ستاره ، در ناحیه بین دو هسته، چگالی الکترونی کمی دارد. اثر نهایی مولکول پای ستاره جدا کردن دو اتم از یکدیگر است.
سطح انرژی اوربیتالهای مولکولی
انرژی یک اوربیتال مولکولی به انرژی اوربیتالهای اتمی تشکیل دهنده آن و همچنین به انرژی اوربیتالهای اتمی تشکیل دهنده آن و همچنین به میزان و نوع همپوشانی اوربیتالهای اتمی که در تشکیل آن صورت میگیرد، بستگی دارد. به این ترتیب، انرژی هر دو اوربیتال مولکولی 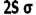 و
و 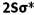 پایین تر از انرژی هر اوربیتال مولکولی است که اوربیتال های اتمی2Pحاصل می شود. انرژی اوربیتال های
پایین تر از انرژی هر اوربیتال مولکولی است که اوربیتال های اتمی2Pحاصل می شود. انرژی اوربیتال های 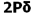 و
و 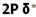 پایین تر از انرژی هر یک از دو اوربیتال
پایین تر از انرژی هر یک از دو اوربیتال 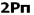 می باشد. زیرا میزان همپوشانی اوربیتال های 2PX بیشتر از میزان همپوشانی 2PY و 2PZ می باشد.
می باشد. زیرا میزان همپوشانی اوربیتال های 2PX بیشتر از میزان همپوشانی 2PY و 2PZ می باشد.
در مولکولهایی که اوربیتالهای مولکولی 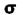 از همپوشانی بین یک اوربیتال Px و s حاصل میشود (تاثیر متقابل s-p)، این همپوشانی اضافی پیوند
از همپوشانی بین یک اوربیتال Px و s حاصل میشود (تاثیر متقابل s-p)، این همپوشانی اضافی پیوند 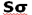 به ازای تضعیف پیوند
به ازای تضعیف پیوند 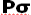 ، تقویت میشود و همچنین تاثیر متقابل s-p باعث کاهش انرژی اوربیتال
، تقویت میشود و همچنین تاثیر متقابل s-p باعث کاهش انرژی اوربیتال 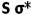 و افزایش انرژی
و افزایش انرژی 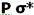 میشود. بنابراین سطح انرژی
میشود. بنابراین سطح انرژی 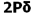 برای مولکولهای جور هسته متشکل از عناصر گروه دوم (به جز O2 و F2 ) پایین تر از سطح انرژی
برای مولکولهای جور هسته متشکل از عناصر گروه دوم (به جز O2 و F2 ) پایین تر از سطح انرژی 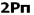 میباشد. البته تاثیر متقابل s-p به میزان نزدیک تر انرژی اوربیتالهای p و s بستگی دارد. اگر تفاوت انرژی این دو اوربیتال خیلی زیاد باشد (مثل O2 و F2 ) این تاثیر اضافی مساله بوجود نمی آورد.
میباشد. البته تاثیر متقابل s-p به میزان نزدیک تر انرژی اوربیتالهای p و s بستگی دارد. اگر تفاوت انرژی این دو اوربیتال خیلی زیاد باشد (مثل O2 و F2 ) این تاثیر اضافی مساله بوجود نمی آورد.
منبع: تبیان